CLIPP – Technologie de résonance plasmonique de surface et microscopie à force atomique pour l'analyse des vésicules extracellulaires contenues dans le plasma humain issu de patients atteints de Myélome Multiple
Le myélome multiple (MM), une hémopathie maligne, est associé au risque le plus élevé de thrombose, en particulier lorsqu'il est traité avec des médicaments immunomodulateurs. Dans le cadre de l'étude METRO1, le CHU (Dr Emilie Chalayer, doctorant M. Sébastien Charles) et la plateforme CLIPP mènent une étude sur les vésicules extracellulaires circulantes (EVs) qui sont impliquées dans des fonctions physiologiques, notamment la coagulation. CLIPP a mis à disposition sa solution analytique NBA2 basée sur une combinaison d'instruments biophysiques (Résonance Plasmonique de Surface et Microscopie à Force Atomique) pour évaluer et décrire tous les types de VEs (petites, moyennes et grandes, d'origine cellulaire) présentes dans le sang des patients atteints de MM et en particulier les microvésicules dérivées de l'endothélium. Une biopuce SPRi développée spécifiquement pour l’étude a permis de capturer et de détecter sélectivement des éléments biologiques (parmi eux, les EVs) tandis que les investigations AFM sur puce ont permis la caractérisation nanométrique de ces éléments (analyses morphologiques et mécaniques des structures). CLIPP a fourni un programme de formation pour le doctorant en 2022 et assuré l’accompagnement ce projet dans sa dimension biophysique. Les résultats ont permis une première vision phénotypique des EVs contenus dans le plasma des patients : une augmentation des EVs CD138+ (comme attendu), CD41a+ et CD14+ dans le plasma de MM au moment du diagnostic. L'analyse AFM est cohérente avec leur nature d'EV. Ces résultats prometteurs ont été récemment récompensés3 et ont ouvert la voie à d'autres investigations avec des échantillons de plasma après le traitement des patients.

Figure: Sébastien CHARLES, doctorant au laboratoire SAINBIOSE, a reçu le prix du meilleur poster pour l'étude biophysique des EVs de patients atteints de myélome multiple réalisée dans les installations de la plateforme CLIPP. SLEIGHT Science Event '2023.
References:
[1] Chalayer, et al. Research and Practice in Thrombosis and Haemostasis 3, 89-90, 2018
[2] Obeid, et al. Biosensors and Bioelectronics 93, 250-259, 2017
[3] S. Charles et al., Extracellular vesicles circulating in blood of multiple myeloma patients: an innovative detection. Poster, SLEIGHT Science Event’2023, France. https://manutech-sleight.com/manutech-sleight-graduate-school/
Criblage de molécules
La plateforme CLIPP est en capacité de cribler des molécules ou des biomolécules de poids moléculaires supérieurs à 1 kDa dans différents types de solvant (eau, DMSO, …). Ce criblage concerne tout type d’immunoglobulines (anticorps, nanobodies) et leurs fragments (VHH, Fab etc..) ainsi que tout interactant de nature biologique et/ou synthétique.
Selon la demande client, nous proposons l’instrumentation SPR la plus adaptée (SPRi via XelPlex , SPR via le Biacore 3000)
Suivant l’appareillage et la méthode de régénération, nous sommes en capacité de cribler de 1 à plusieurs dizaines de molécules sur une multitude de cibles immobilisées (3 à 64). Nous obtenons ainsi des données cinétiques et thermodynamiques de l’interaction entre les partenaires.
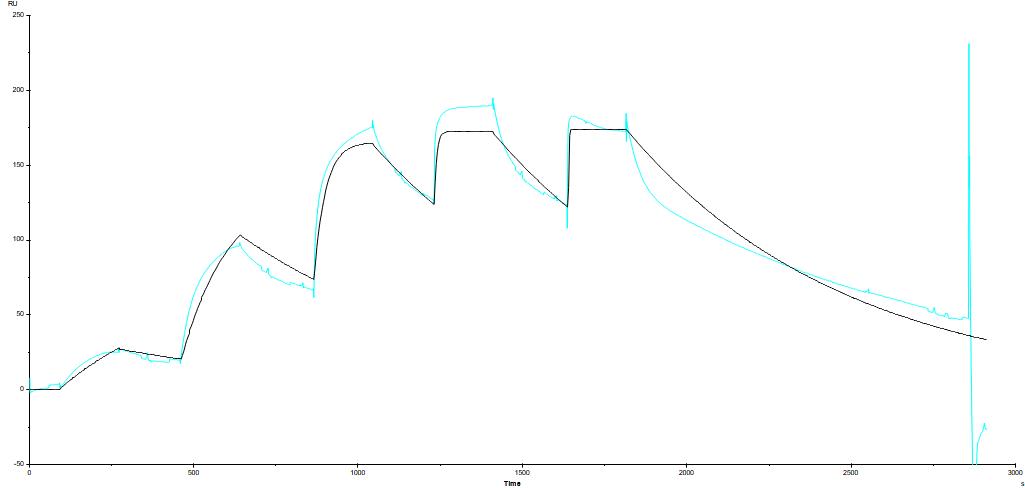
Vous trouverez ci-dessous un exemple d’analyse de 14 molécules (analytes) en mode « Single Cycle Kinetic » vis à vis d’une cible.
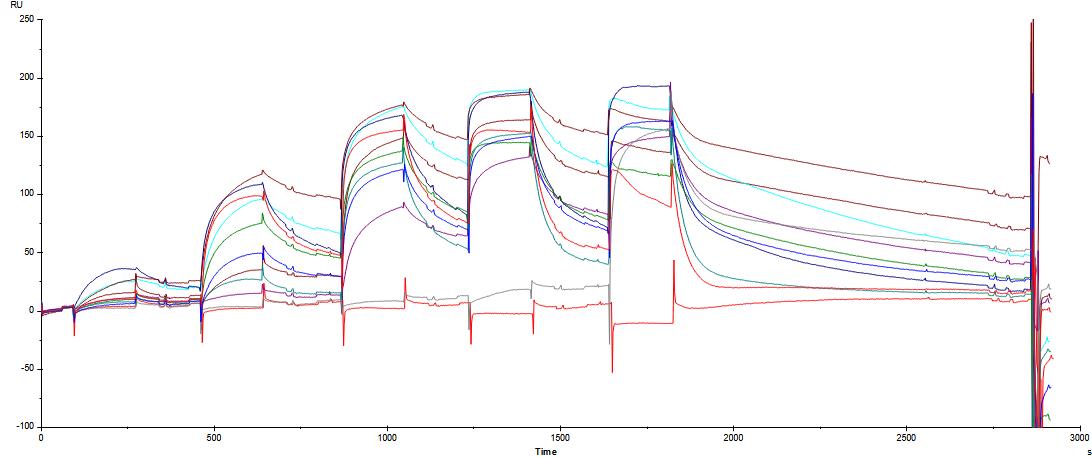
Des fits cinétiques permettent de cribler chaque molécules vis à vis de leur cible et de déterminer leur constante de dissociation à partir des réponses à l’équilibre (Figure 2).
Projet Qualification EVs programme EVs-TEST (LAAS – Toulouse) Février 2024 / Août 2025
La plateforme CLIPP participe au développement du projet « EVTest » soutenu par le programme pré-maturation du CNRS et dont le porteur est le Dr Anne Marie Gué (LAAS/CNRS). Ce projet vise au développement d’un dispositif miniaturisé permettant l’isolement et la classification de particules sub-micrométriques circulant dans les fluides complexes. Il cible particulièrement les applications biologiques et médicales au travers des vésicules extracellulaires (EVs) circulant dans les échantillons biologiques (sang en particulier). Suite du projet ANR « MADNESS » Le dispositif combine 2 modules microfluidiques: le premier isolant les particules sur un critère de taille par filtration hydrodynamique (technologie développée au sein du LAAS), le second sélectionnant les sous-populations d’EVs par imuno-capture (développé par FEMTO-ST). Le dispositif est conçu de telle manière que les sous-populations isolées peuvent être par la suite étudiées et analysées à l'aide de techniques analytiques établies (fluorescence, AFM, …) et multiomiques.

